ທັງສອງ ທາດປະກອບເຄມີ ຍ້ອນວ່າອົງປະກອບທາງເຄມີຖືກສ້າງຂຶ້ນຈາກໂມເລກຸນ, ແລະສິ່ງເຫຼົ່ານີ້ແມ່ນສ້າງຂື້ນຈາກປະລໍາມະນູ. ປະລໍາມະນູຍັງຄົງສາມັກຄີຂອບໃຈກັບການສ້າງອັນທີ່ເອີ້ນວ່າ ການເຊື່ອມຕໍ່ສານເຄມີ.
ທ ພັນທະບັດເຄມີແມ່ນບໍ່ຄືກັນ: ໂດຍພື້ນຖານແລ້ວພວກມັນຂື້ນກັບຄຸນລັກສະນະເອເລັກໂຕຣນິກຂອງອະຕອມທີ່ກ່ຽວຂ້ອງ. ມັນມີສອງປະເພດທີ່ມັກເຊື່ອມໂຍງກັນ: ພັນທະບັດ ionic ແລະ ພັນທະບັດ covalent.
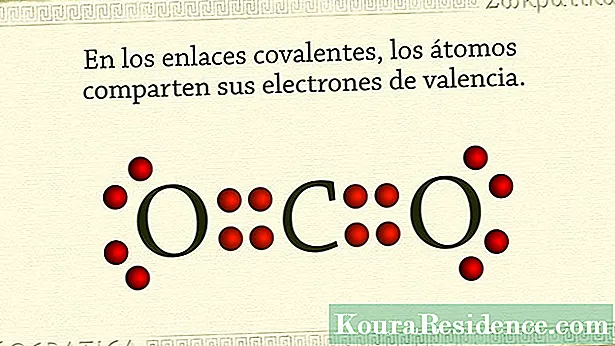
ໂດຍປົກກະຕິ, ພັນທະບັດ covalent ແມ່ນສິ່ງນັ້ນ ຖືປະລໍາມະນູທີ່ບໍ່ແມ່ນໂລຫະຮ່ວມກັນ. ມັນເກີດຂື້ນວ່າອະຕອມຂອງອົງປະກອບເຫຼົ່ານີ້ມີເອເລັກໂຕຣນິກຫຼາຍຢູ່ໃນຫອຍທີ່ຢູ່ທາງນອກຂອງພວກມັນແລະມີແນວໂນ້ມທີ່ຈະຮັກສາຫຼືໄດ້ຮັບເອເລັກໂຕຣນິກ, ແທນທີ່ຈະປ່ອຍມັນ.
ນັ້ນແມ່ນເຫດຜົນທີ່ວິທີການທີ່ສານເຫຼົ່ານີ້ຫຼືສານເຄມີຕ່າງໆຮູບສັນຍາລັກບັນລຸສະຖຽນລະພາບແມ່ນການແບ່ງປັນເອເລັກໂຕຣນິກຄູ່, uບໍ່ໄດ້ມາຈາກທຸກໆປະລໍາມະນູ. ດ້ວຍວິທີນີ້ເອເລັກໂຕຣນິກທີ່ໃຊ້ຮ່ວມກັນແມ່ນ ທຳ ມະດາ ສຳ ລັບສອງອະຕອມແລະໃນເວລາດຽວກັນເຮັດໃຫ້ພວກມັນຢູ່ ນຳ ກັນ. ໃນ ທາດອາຍຜິດ ຍົກຕົວຢ່າງ, ສິ່ງນີ້ເກີດຂື້ນ. ເຊັ່ນດຽວກັນໃນອົງປະກອບ halogen.
ໃນເວລາທີ່ພັນທະບັດ covalent ເກີດຂື້ນລະຫວ່າງອົງປະກອບຂອງ electronegativity ທີ່ຄ້າຍຄືກັນ, ຄືກັນກັບລະຫວ່າງ hydrogen ແລະ carbon, ພັນທະບັດຈະຖືກສ້າງຂຶ້ນ apolar covalent. ນີ້ເກີດຂື້ນ, ຍົກຕົວຢ່າງ, ໃນ hydrocarbons.
ເຊັ່ນດຽວກັນ, ໂມເລກຸນທີ່ບໍ່ແນ່ນອນ (ປະກອບດ້ວຍອະຕອມດຽວກັນ) ກໍ່ປະກອບເປັນປົກກະຕິ ພັນທະບັດ apolar. ແຕ່ຖ້າຄວາມຜູກພັນເກີດຂື້ນລະຫວ່າງອົງປະກອບຂອງ electronegativity ທີ່ແຕກຕ່າງກັນ, ຄວາມ ໜາ ແໜ້ນ ຂອງເອເລັກໂຕຣນິກທີ່ສູງຂື້ນແມ່ນຜະລິດຢູ່ໃນປະລໍາມະນູ ໜຶ່ງ ກ່ວາໃນອີກປະການ ໜຶ່ງ, ເປັນຜົນມາຈາກການເກີດຂົ້ວນີ້.
ຄວາມເປັນໄປໄດ້ທີສາມແມ່ນວ່າສອງປະລໍາມະນູແບ່ງປັນເອເລັກໂຕຣນິກຄູ່, ແຕ່ວ່າເອເລັກໂຕຣນິກທີ່ໃຊ້ຮ່ວມກັນເຫຼົ່ານີ້ແມ່ນປະກອບສ່ວນໂດຍມີພຽງແຕ່ປະລໍາມະນູຂອງມັນເທົ່ານັ້ນ. ໃນກໍລະນີນັ້ນພວກເຮົາເວົ້າເຖິງ dative ຫຼືປະສານງານພັນທະບັດ covalent.
ສໍາລັບ link dative ທ່ານຕ້ອງການອົງປະກອບທີ່ມີຄູ່ເອເລັກໂຕຣນິກທີ່ບໍ່ເສຍຄ່າ (ຄືໄນໂຕຣເຈນ) ແລະອີກຢ່າງ ໜຶ່ງ ທີ່ຂາດທາດເອເລັກໂຕຣນິກ (ຄືກັບໄຮໂດເຈນ). ມັນຍັງມີຄວາມ ຈຳ ເປັນທີ່ຜູ້ທີ່ມີຄູ່ອີເລັກໂທຣນິກແມ່ນໄຟຟ້າພຽງພໍທີ່ຈະບໍ່ສູນເສຍເອເລັກໂຕຣນິກທີ່ຈະແບ່ງປັນ. ສະຖານະການນີ້ເກີດຂື້ນ, ຍົກຕົວຢ່າງ, ໃນ ammonium (NH4+).
ທ ສານ ບັນຈຸທາດປະສົມພັນ covalent ສາມາດເກີດຂື້ນໃນສະພາບການຕ່າງໆ (ແຂງ, ທາດແຫຼວຫຼືທາດອາຍຜິດ) ແລະໂດຍທົ່ວໄປ ພວກເຂົາເຈົ້າແມ່ນ conductors ບໍ່ດີຂອງຄວາມຮ້ອນແລະໄຟຟ້າ.
ພວກເຂົາມັກຈະສະແດງ ຈຸດທີ່ຂ້ອນຂ້າງລະລາຍຕໍ່າແລະຈຸດຮ້ອນ ອ ປົກກະຕິແລ້ວແມ່ນລະລາຍໃນສານລະລາຍຂົ້ວໂລກເຊັ່ນ benzene ຫຼື tetrachloride ກາກບອນ, ແຕ່ພວກມັນມີສານລະລາຍບໍ່ດີໃນນໍ້າ. ພວກເຂົາມີຄວາມຫມັ້ນຄົງທີ່ສຸດ.
ຕົວຢ່າງຂອງທາດປະສົມຫລືສານທີ່ບັນຈຸພັນທະບັດ covalent ສາມາດໃຫ້ໄດ້:
- fluorine
- Bromine
- ທາດໄອໂອດິນ
- chlorine
- ອົກຊີເຈນ
- ນໍ້າ
- ຄາບອນໄດອອກໄຊ
- ອາໂມເນຍ
- Methane
- Propane
- ສິລິກາ
- ເພັດ
- Graphite
- Quartz
- ກູໂກ
- ປາຣາຟິນ
- ກາຊວນ
- ໄນໂຕຣເຈນ
- Helium
- Freon


