ກະວີ:
Laura McKinney
ວັນທີຂອງການສ້າງ:
9 ເດືອນເມສາ 2021
ວັນທີປັບປຸງ:
14 ເດືອນພຶດສະພາ 2024
ເນື້ອຫາ
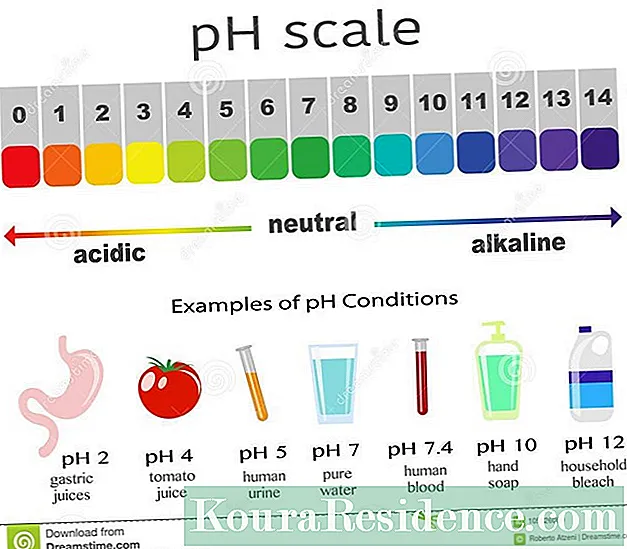
ອີງຕາມຄວາມເປັນກົດຂອງພວກມັນ, ສານຕ່າງໆຖືກຈັດເຂົ້າໃນ ເປັນກົດ, ເປັນດ່າງຫຼື ເປັນກາງ. ອາຊິດຖືກວັດແທກໃນ ນ, ເຊິ່ງຢືນສໍາລັບ hydrogen ທີ່ມີທ່າແຮງ. ສານທີ່ເປັນກາງມີ pH 7.
ສານທີ່ມີ pH ຕໍ່າກວ່າ 7, ແມ່ນສານທີ່ເປັນກົດ. ລະດັບນໍ້າສົ້ມທີ່ສູງທີ່ສຸດແມ່ນ pH 0. ຄວາມເປັນກົດມີຄວາມ ໝາຍ ວ່າຄວາມເຂັ້ມຂົ້ນຂອງໄອອອນໄຮໂດເຈນຄິດຄ່າບວກແມ່ນສູງກ່ວາທາດອາຍໄຮໂດຼລິກທີ່ຖືກຄິດຄ່າລົບ (hydrogen ແລະ oxygen).
ອາຊິດແມ່ນສະແດງໂດຍ:
- ລົດຊາດສົ້ມ
- Redden ເຈ້ຍ litmus
- ຜະລິດກະແສໄຟຟ້າດ້ວຍສານແຄວຊຽມຄາບອນ
- ພວກມັນປະຕິກິລິຍາກັບໂລຫະບາງຊະນິດເຊັ່ນ: ສັງກະສີຫຼືທາດເຫຼັກ.
- ພວກເຂົາເຈົ້າ neutralize ຖານຂໍ້
- ໃນການແກ້ໄຂທີ່ມີນ້ ຳ ໜັກ ພວກມັນ ອຳ ນວຍຄວາມສະດວກໃຫ້ແກ່ກະແສໄຟຟ້າ
- ພວກມັນເສື່ອມສະພາບກັບເນື້ອເຍື່ອຊີວະພາບເຊັ່ນ: ຜິວ ໜັງ
- ລະລາຍສານ
ຜູ້ທີ່ມີ pH ໃຫຍ່ກວ່າ 7, ແມ່ນສານທີ່ເປັນດ່າງ. ລະດັບຄວາມເປັນດ່າງສູງທີ່ສຸດແມ່ນ pH 14. Alkalinity ໝາຍ ຄວາມວ່າຄວາມເຂັ້ມຂົ້ນຂອງໄອອອນ hydroxyl ທີ່ຖືກຄິດໄລ່ໃນແງ່ລົບ (hydrogen ແລະ oxygen) ແມ່ນສູງກ່ວາ ions hydrogen hydrogen ທີ່ຄິດຄ່າບວກ. ເປັນດ່າງ, ເອີ້ນວ່າຍັງຖານ, ແມ່ນສະໂດຍ:
- ລົດຊາດຂົມ
- ເຈ້ຍ litmus ກະເບື້ອງ
- ພວກເຂົາເຈົ້າແມ່ນ unctuous ກັບການສໍາພັດໄດ້
- ສານທີ່ຖືກລະລາຍໂດຍທາດອາຊິດ precipitate
- ໃນການແກ້ໄຂທີ່ມີນ້ ຳ ໜັກ ພວກມັນກໍ່ສ້າງຄວາມສະດວກໃຫ້ແກ່ກະແສໄຟຟ້າ
- ລະລາຍໄຂມັນແລະຊູນຟູຣິກ
- ພວກມັນເປັນກາງ
ຕົວຢ່າງຂອງສານທີ່ເປັນກາງ
- ນົມ: ນົມແມ່ນສານທີ່ເປັນກາງ (pH 6.5). ເຖິງຢ່າງໃດກໍ່ຕາມ, ເມື່ອມີການພົວພັນກັບນໍ້າກະເພາະ, ມັນຈະກາຍເປັນສານທີ່ເປັນກົດ, ດັ່ງນັ້ນ, ກົງກັນຂ້າມກັບສິ່ງທີ່ເຊື່ອກັນທົ່ວໄປ, ມັນບໍ່ໄດ້ຖືກແນະນໍາໃຫ້ບໍລິໂພກໃນເວລາທີ່ເຈັບຫົວໃຈ.
- ນໍ້າແລ່ນ: ນ້ ຳ ປະປາຫລືນ້ ຳ ປະປາຕ້ອງເປັນສານທີ່ເປັນກາງ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ນ້ ຳ ສາມາດເປັນທາດ ionized ໄດ້, ໝາຍ ຄວາມວ່າທາດຢູໂຣນຽມຂອງມັນສາມາດເພີ່ມຂື້ນ (ຄິດຄ່າບວກ) ແລະກາຍເປັນກົດ.
- ນ້ ຳ ແຮ່ທາດທີ່ມີກາs: ແຮ່ທາດແລະອາຍແກັສໃນນ້ ຳ ດື່ມບໍ່ປ່ຽນແປງລະດັບ pH ຂອງນ້ ຳ ຢ່າງຫຼວງຫຼາຍ.
- ນ້ ຳ ແຮ່ທາດໂດຍບໍ່ມີອາຍແກັສ
- ສະບູແຫຼວ: ຜິວ ໜັງ ແມ່ນສະພາບແວດລ້ອມທີ່ເປັນກົດ (pH 5.5 ປະມານ) ໃນຂະນະທີ່ສະບູທີ່ແຂງມີ pH ສູງກ່ວາ 8. ສະບູນໍ້າມັນແມ່ນຜະລິດຕະພັນສັງເຄາະເຊິ່ງນໍ້າສົ້ມຈະຖືກເພີ່ມເພື່ອບັນລຸ pH ທີ່ເປັນກາງ. ສະບູ Glycerin ຖືກກ່າວເຖິງວ່າ "ເປັນກາງ" ເພາະວ່າມັນມີ pH ຄ້າຍຄືກັບຜິວ ໜັງ, ແຕ່ທາງເຄມີແມ່ນສານທີ່ເປັນກົດ, ເພາະວ່າ pH ຂອງມັນຕໍ່າກວ່າ 7.
- ສະບູ່ຊັກຜ້າ: ສະບູທີ່ບໍ່ເປັນກາງແມ່ນບໍ່ມີຄວາມຫຍາບຄາຍຕໍ່ກັບຜ້າຫຼາຍກວ່າສະບູທີ່ເປັນກົດ.
- ເລືອດ: ລະຫວ່າງ 7.3 ແລະ 7.4
- ນໍ້າລາຍ: ລະຫວ່າງ 6.5 ແລະ 7.4


